DIÁRIO DE BORDO: Feigenbaum ficou conhecido pela introdução do termo Total Quality Control
(TQC) em 1961. Em sua abordagem, a qualidade deixa de ser responsabilidade de
um departamento especializado em controle da qualidade e passa a ser função de
todas as áreas da empresa. Para coordenar as atividades de todas as áreas da
empresa no controle da qualidade, Feigenbaum sugere uma estrutura sistêmica:
"há necessidade de um sistema efetivo para integrar esforços relativos ao
desenvolvimento, manutenção e melhoria da qualidade a todos os grupos da
organização, de forma a habilitar áreas essenciais da empresa, como marketing,
engenharia, produção e serviços, a desenvolverem suas atividades a um nível
mais econômico possível, com a finalidade primeira de atender, plenamente, às
necessidades do consumidor." Veja abaixo os princípios do TQC:
bpexcelencia.blogspot.com tem a função de trazer informação útil sobre as atividades dos setores regulados (farmacêutico alimentício e cosmético)
no sentido de ajudar no desempenho, demonstração e manutenção do estado de certificação das Boas Práticas
através de artigos com abordagens estratégicas, comentários, tópicos de treinamentos, ferramentas e estudos de caso.
Assim como informações sobre a conduta e desenvolvimento das pessoas envolvidas neste segmento.
domingo, 5 de janeiro de 2014
domingo, 1 de dezembro de 2013
O QUE É QUALITY BY DESIGN (QbD) E O QUAL O SEU SIGNIFICADO PARA A INDÚSTRIA FARMACÊUTICA?
DIÁRIO DE BORDO: A
qualidade para produto farmacêutico é medida pela sua adequação ao uso
terapêutico, pela sua especificação e atributos e seu acesso tanto no que se
refere tanto à sua distribuição quanto pelo seu custo. E uma característica
básica é que a o aspecto segurança e o aspecto qualidade não podem ser
separáveis por causa do risco sanitário embutido na sua utilização. Desta
preocupação surgiram as Boas Práticas de Fabricação, um código legal dos
princípios de qualidade aplicados na fabricação e controle de produtos
farmacêuticos cujo objetivo é garantir que as matérias-primas, utilizadas na
fabricação dos medicamentos sejam padronizadas e livres de contaminações; o
processo de fabricação seja capaz de produzir um produto farmacêutico dentro
dos atributos de qualidade previstos e que medições e ensaios adequados foram
utilizados para assegurar as especificações de qualidade até o final do seu
prazo de validade. Desta maneira os fabricantes podem perder alguns lotes
até as reais causas de falha ser compreendidas e solucionadas. Tais
especificações rigorosas podem resultar em recolhimentos de produto e falta de
medicamentos no mercado. Recursos significativos são desperdiçados debatendo-se
problemas relacionados à aceitação da variação, necessidade de testes adicionais
de controle, e estabelecimento de critérios de aceitação. Requisitos
regulatórios impõem notificações para a execução de mudanças mínimas e
incrementais nos processos e controles inibindo assim melhorias contínuas e
estratégias para implantação da garantia da qualidade em tempo real.
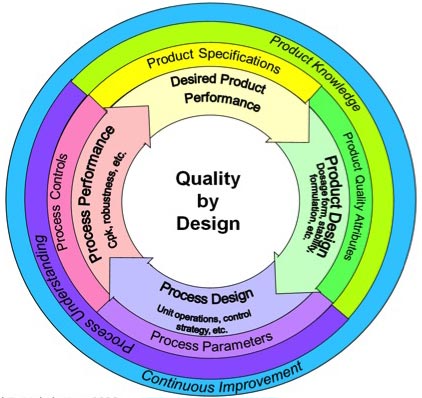
O QbD surge desta
necessidade de maior flexibilização nos processos de fabricação, pois
apresenta-se com uma abordagem proativa, sistemática, científica, com base em
análise de risco do desenvolvimento farmacêutico. Começa com objetivos
pré-definidos e com destaque nas concepções do produto, do processo e do
controle. Isto significa planejar e desenvolver formulações e processos de
manufatura que garantam os objetivos pré-definidos da qualidade do produto
através da identificação das características críticas de qualidade do ponto de
vista do paciente, traduzindo-se em atributos que o produto deve apresentar
independentemente das variações dos parâmetros críticos do processo. Para fazer
isto as relações entre as variáveis da formulação e do processo produtivo
(incluindo os atributos dos insumos ativos e dos excipientes, assim como os
parâmetros do processo) e as características do produto são estabelecidas e as
fontes de variação identificadas. O conhecimento assim adquirido é utilizado
para implementar um robusto e flexível processo de manufatura que pode se
ajustar e produzir um produto consistente repetidamente.
No modelo QbD, a
qualidade do medicamento é assegurada pelo entendimento e controle das
variáveis de formulação e de manufatura. Os ensaios analíticos aplicados ao
produto terminado apenas confirmam a sua qualidade. No modelo atual a
especificação é frequentemente fixada pela observação de dados de um pequeno
número de lotes que fixam os critérios de aceitação para os futuros lotes a
serem produzidos. No modelo QbD a consistência vem do planejamento e controle
do processo produtivo e da especificação do medicamento.
O
termo “Quality by Design” foi criado na década de 60 por Joseph M. Juran um
engenheiro que acreditava que a maioria dos problemas referentes à qualidade de
um produto está relacionada com o modo como o desenvolvimento deste produto foi
realizado e assim sendo quanto mais sistemáticos os estudos para a definição e
adequação do uso pretendido e, quanto mais detalhadas as características que
garantem a sua eficácia durante a fase de desenvolvimento deste produto, quanto
melhor o seu desempenho na fase produção e comercialização. Portanto,
para Juran o produto deve ser concebido e construído levando-se em
consideração a qualidade, a segurança e efetividade; a qualidade não
pode ser testada no produto; e cada etapa do processo deve ser controlada para
maximizar a probabilidade de que o produto final alcance seus atributos de
qualidade e as especificações (“Quality Control Handbook” -1950)
O QbD
foi proposto primeiramente pela agencia reguladora dos EUA ( FDA- a partir de
2002) e seguida pela agencia reguladora da comunidade europeia (EMA) e pela
agencia reguladora do Japão (PMDA). O processo está sendo conduzido pelo ICH
(International Conference on Harmonization) entidade em que participam grupos
destas três agencias reguladoras. O ICH já desenvolveu três guias que orientam
para os conceitos de QbD, a saber:
• ICH-Q8 Desenvolvimento
Farmacêutico (2004)
• ICH-Q9
Gerenciamento do Risco da Qualidade (2006)
• ICH-Q10
Sistema Farmacêutico da Qualidade (2007)
Estas
guias começam a ser internalizadas nas agencias reguladoras dos EUA e EMA a
partir de 2012.
No
Brasil alguns conceitos começam a ser incentivados pela ANVISA e praticados
pelos fabricantes, tais como o gerenciamento de risco, o incremento do controle de mudanças e o monitoramento
periódico do desempenho do produto durante todo o ciclo de vida do produto.
terça-feira, 12 de novembro de 2013
Anvisa publica novos regulamentos de BPF para saneantes e cosméticos
DIÁRIO DE BORDO: As duas normas, publicadas em 28 de outubro de 2013, foram alinhadas a outras normas da Anvisa, e ao ordenamento jurídico do Mercosul . Com a publicação foram revogadas as Portarias 327/97 e 348/97. Os novos regulamentos, além de modernizarem as normas existentes, mudaram a lógica de inspeção reorganizando os tópicos e eliminando o roteiro de inspeção. O foco é a avaliação do risco e o fortalecimento do gerenciamento da qualidade.
O objetivo do novo regulamento de saneantes é normatizar a fabricação, de modo que os fatores humanos, técnicos e administrativos (da fabricação), que podem ter influência na qualidade dos mesmos, sejam eficazmente controlados, visando prevenir, reduzir e eliminar qualquer deficiência na qualidade dos mesmos, que podem afetar negativamente a saúde e segurança do usuário. Clique abaixo para ver a norma na íntegra.
RDC nº 48, de 25 de outubro de 2013 Boas Práticas de Fabricação para produtos de Higiene Pessoal, Cosméticos -
A norma estabelece os procedimentos e as práticas que os fabricantes de cosméticos em geral devem aplicar para assegurar que as instalações, métodos, processos, sistemas e controles usados para a fabricação de produtos de higiene pessoal, cosméticos e perfumes sejam adequados de modo a garantir qualidade desses produtos.Clique abaixo para ver a norma na íntegra.
sexta-feira, 1 de novembro de 2013
GURUS DA QUALIDADE: PHILIP BAYARD CROSBY
DIÁRIO DE BORDO: Crosby, o pai da filosofia Zero Defeito, se baseia na teoria de que a
qualidade é assegurada se todos se esforçarem em fazer seu trabalho
corretamente da primeira vez. Para ele a qualidade é responsabilidade dos
trabalhadores. Crosby instituiu seus 14 pontos, que
constituem as etapas de implementação de sua abordagem, são eles:
1)Dedicação da alta gerência e comprometimento através da elaboração de um documento com a política e os objetivos da empresa;
2)Constituição de equipes para melhorias coordenadas pelos gerentes;
3)Medição dos resultados;
4)Avaliação dos custos da qualidade;
5)Comunicação dos resultados aos supervisares e operários;
6)Reunião para identificação dos problemas;
7)Estabelecimento de um comitê informal para a divulgação do programa;
8)Treinamento da gerência e supervisão;
9) Instauração do dia Zero Defeitos, onde os resultados anuais são divulgados
e efetua-se o reconhecimento a todos os participantes do programa;
10)Estabelecimento dos objetivos a serem seguidos;
11)Consulta aos operários sobre a origem dos problemas;
12)Recompensar aqueles que atingiram os seus objetivos;
13)Formar os conselhos da qualidade;
14)Etapa final: faça tudo de novo.
Sua filosofia é voltada mais para o comportamento humano, como único meio
para se garantir a qualidade. O comportamento humano "Zero Defeito" é
conseguido através da motivação. Esta abordagem a curto prazo pode
atingir alguns resultados positivos, no entanto, a longo prazo a motivação das
pessoas pode acabar diminuindo e a sustentação do programa de qualidade pode ficar comprometida.
João de Araújo Prado Neto, Maio 2013.
sexta-feira, 4 de outubro de 2013
GURUS DA QUALIDADE: WALTER ANDREW SHEWART
DIÁRIO DE BORDO: A contribuição mais importante de Shewhart tanto para a Estatística quanto para a indústria foi o desenvolvimento do Controle Estatístico de Qualidade. A ideia era incorporar o uso de várias aleatórias independentes e identicamente distribuídas. O princípio geral por trás da ideia é que quando um processo está em estado de controle e seguindo uma distribuição particular com certos parâmetros o propósito é determinar quando o processo se afasta deste estado e as ações corretivas que devem ser tomadas.
Princípio geral: Considerando-se um
processo está em estado de controle e seguindo uma
distribuição particular com
certos parâmetros o propósito é determinar quando o processo se
afasta deste
estado e as ações corretivas que devem ser tomadas.
Gráfico X-Barra: Shewhart
desenvolveu “linhas de ação” do tipo m ± k.s/raiz(n), onde “s” é o desvio padrão e “k” é uma constante que ele determinou como sendo aproximadamente
três.Se o processo se desvia da média fixada, um sinal é dado se a média da
amostra cai fora das linhas de ação.
As contribuições de Shewhart tanto para a indústria quanto a Estatística foram significativas e sua influência sobre estatísticos como W. E. Deming resultaram na melhoria dos processos e na alta qualidade na indústria que ocasionaram o grande desenvolvimento Japonês do século vinte.
João de A´raujo prado Neto, Maio de 2013.
terça-feira, 3 de setembro de 2013
GURUS DA QUALIDADE: JOSEPH MOSES JURAN
DIÁRIO DE BORDO: As principais contribuições de Juran foram na definição e organização dos
custos da qualidade e no enfoque da qualidade como uma atividade
administrativa. Juran atribui a responsabilidade pela qualidade final do
produto ou serviço à função qualidade, que segundo ele é o conjunto
das atividades através das quais atingimos a adequação ao uso, não importando
em que parte da organização estas atividades são executadas.
Para garantir que a função qualidade seja executada de modo a atingir os
melhores resultados, Juran propôs uma trilogia de atividades:
-Planejamento da Qualidade
•Identifique quem são os
clientes.
•Determine as necessidades
dos clientes.
•Traduza estas
necessidades para a linguagem da empresa.
-Controle da Qualidade
•Desenvolva um processo
apto a produzir o produto.
•Otimize o processo.
-Aperfeiçoamento da Qualidade
•Prove que o processo pode
produzir o produto nas condições de operação com o mínimo de
inspeção.
•Transfira o processo para
a produção.
A implantação desta abordagem é baseada na formação de equipes para a resolução de problemas, um a um, melhorando a qualidade continuamente.
João de Araújo Prado Neto, Maio de 2013
quinta-feira, 8 de agosto de 2013
GURUS DA QUALIDADE: DEMING
DIÁRIO DE BORDO: William Edward Deming, reconhecido mundialmente como o grande promotor do Controle da Qualidade no
Japão, deixou grandes contribuições para o desenvolvimento da qualidade. Sua
abordagem é baseada no uso de técnicas estatísticas para reduzir custos e
aumentar a produtividade e qualidade. Para descrever sua filosofia,
Deming definiu 14 pontos:
1.Criar uma constância de propósitos de melhorar produtos e
serviços;
2.Adotar a nova filosofia e iniciar um movimento por mudanças;
3.Deixar de contar com a inspeção em massa, a qualidade não se
origina da inspeção, mas
do melhoramento do processo;
4.Acabar com o sistema de compras baseado apenas no preço;
5.Melhorar constantemente o sistema de produção e serviço;
6.lmplantar
métodos de treinamento no trabalho;
7.lmplantar
métodos de supervisão, instituir a liderança;
8.Expulsar o medo da organização;
9.Romper as barreiras entre as áreas e Staff,
10.Eliminar Slogans, exortações e metas para a mão-de-obra, sem no entanto,
oferecer
meios para alcançá-las;
11.Eliminar os padrões de trabalho e cotas numéricas;
12.Eliminar as barreiras que privam o empregado de ter orgulho do
seu trabalho;
13.Retreinamento contínuo;
14.Criar um estrutura na alta administração que tenha como função
implantar os 13 pontos
anteriores.
Deming não apresenta um sistema estruturado ou metodologia, seu enfoque está no controle e melhoria de processo, portanto é considerado o criador da abordagem PDCA. uma poderosa ferramenta de melhoria contínua que constitui o cerne do sistema de gestão da qualidade.
João de Araújo Prado Neto, Maio 2013.
Assinar:
Comentários (Atom)